Brustkrebsgene
DNA-Schäden stören die Genom-Stabilität und können Krebs verursachen
Die Zellen aller Organismen unterliegen ständigem Stress. Dieser Stress kann durch Umweltfaktoren wie Strahlung verursacht werden, aber auch innerhalb der Zelle auftreten. Täglich werden mehr als 104 Basen in jeder Zelle geschädigt, daher gehört die Erhaltung der genomischen Stabilität durch Reparatur entstandener Schäden zu einer der wichtigsten Aufgaben einer Zelle. Besonders Pflanzen sind durch ihre sessile Lebensweise auf eine effektive Reparatur-Maschinerie angewiesen. Im Laufe der Evolution hat sich daher ein großes Netzwerk unterschiedlicher Signalwege entwickelt, um auf die vielfältigen Modifikationen der DNA reagieren zu können. Zu diesen Veränderungen gehören beispielsweise Basenmodifikationen sowie Einzel- und Doppelstrangbrüche.
Diese DNA-Schäden können spontan entstehen oder durch Licht, hohe Temperaturen, oxidierende Stoffwechselprodukte und weitere mutagene Substanzen induziert werden. Die Folgen dieser Veränderungen sind meist negativ, da sie vom Verlust zellulärer Funktionen bis hin zu unkontrollierter Zellteilung und zum Zelltod führen können. Werden die entstandenen Schäden also nicht repariert kann dies fatale Folgen für den betroffenen Organismus haben. Gerade die unkontrollierte Teilung von Zellen spielt bei der Entwicklung von Krebs im Menschen eine entscheidende Rolle. Hier gehört Brustkrebs zu den bedeutendsten Krankheiten bei Frauen in der westlichen Welt. Jährlich gibt es allein in Deutschland etwa 50.000 Neuerkrankungen und mehr als 20.000 Sterbefälle auf Grund dieser Erkrankung.
Brustkrebs entsteht meist spontan durch Mutationen in Genen, die die Stabilität und Integrität des Genoms gewährleisten sollen. Bei etwa 10 % der Patienten ist die Krankheit jedoch erblich bedingt. 1990 wurde erstmals ein Gen auf dem menschlichen Chromosom 17 mit dieser Krankheit in Verbindung gebracht. Es wurde BRCA1 genannt, was für breast cancer susceptibility gene 1 steht. Das BRCA1-Protein wirkt als Tumorsuppressor, weil es eine wichtige Rolle in der DNA-Reparatur und somit bei der Unterdrückung der Tumorentstehung spielt. Dabei ist es nicht direkt an der Reparatur beteiligt, wie z.B. die RecQ-Helikasen, es hat vielmehr eine Vermittlerrolle. Das bedeutet, dass BRCA1 andere Proteine zum DNA-Schaden leitet, die dann die Reparatur durchführen. Der Name des Gens verdeutlicht, dass heterozygot vererbte Mutationen das Risiko an Brustkrebs zu erkranken erhöhen. Homozygote Mutationen sind dagegen durch eine frühe embryonale Letalität bei Säugern gekennzeichnet, was die fundamentale Bedeutung während der Entwicklung zeigt, aber gleichzeitig die Erforschung in Säugetieren erschwert.
Brustkrebsgene gibt es auch in Pflanzen
Überraschenderweise konnte 2003 ein Homolog zum menschlichen BRCA1-Gen und kurze Zeit später auch einige seiner Interaktionspartner in Pflanzen identifiziert werden. Die Tatsache, dass die entsprechenden homozygoten Mutanten lebensfähig und voll fertil sind, eröffnet eine neue Möglichkeit zur Erforschung dieser Gene in einem lebenden System. Die darin gewonnenen Erkenntnisse könnten dann auf den Menschen übertragen werden, da BRCA1 und seine Partner allgemein verbreitet sind.
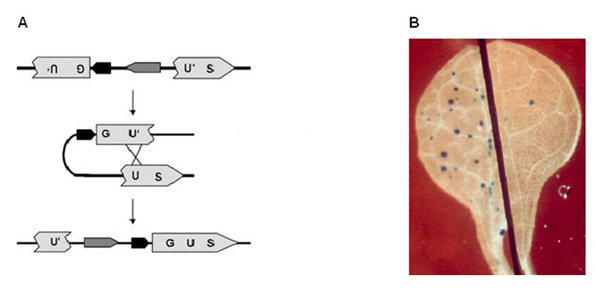
Um die Rolle von BRCA1 und seinen Partnern in der DNA-Reparatur in Pflanzen zu verstehen, nutzen wir das Prinzip der reversen Genetik. Dabei sollen bekannten Genen, hier den Brustkrebsgenen, ihre jeweiligen Funktionen zugeordnet werden indem man diese ausschaltet (Knockout). Zum gezielten Ausschalten von Genen gibt es in Pflanzen verschiedene Möglichkeiten. Eine dieser Methoden ist die RNA Interferenz, bei der kleine RNAs spezifisch an die Ziel-mRNA binden und ihre Degradation veranlassen. So konnte mit Hilfe von Mutanten in unserer Arbeitsgruppe schon gezeigt werden, dass BRCA1 auch in Pflanzen an der DNA-Reparatur durch homologe Rekombination beteiligt ist. Wir nutzen dafür ein System bei dem die Enzymaktivität eines Reporters die Fähigkeit zur Reparatur anzeigt, welche als blaue Punkte auf den Pflanzen detektiert werden kann (Abbildung 1).
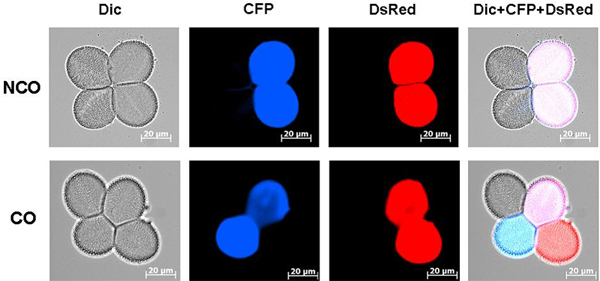
Zudem sind wir auch an meiotischen Vorgängen interessiert. Aus Säugern wissen wir, dass, wie oben beschrieben, homozygote Mutationen in den Brustkrebsgenen embryoletal sind. BRCA1 könnte also auch eine Rolle in der Meiose spielen. Um dies in Pflanzen zu analysieren, kann die Fluoreszenzmikroskopie genutzt werden. Im Mikroskop kann man die Häufigkeit von Rekombinationsereignissen in den Pollen untersuchen. Dazu werden Fluoreszenzmarker benutzt die nahe beieinander auf demselben Chromosom vorliegen. Werden diese durch Rekombination in der Meiose entkoppelt, kann das mikroskopisch beobachtet werden. Das Auszählen der Rekombinationsereignisse und der Vergleich mit Wildtyp-Pflanzen lässt eine Aussage über die Beteiligung der Proteine an der meiotischen Rekombination zu (Abbildung 2).
Abbildung 1: Detektion homologer Rekombination in Pflanzen. (A) Das Reporterkonstrukt ist eine T-DNA, die u.a. aus zwei Teilen des GUS-Gens besteht und bei dem Teilbereiche (U´) zueinander identisch (homolog) sind. Kommt es im Bereich dieses Reportersystems zu DNA-Doppelstrangbrüchen, so können diese durch homologe Rekombination repariert werden. Diese Reaktion führt zur Bildung eines vollständigen GUS-Gens, dessen Aktivität histochemisch nachgewiesen werden kann. (B) Blatthälften von Arabidopsis-Pflanzen, links nach Mutagen-Behandlung, rechts die Kontrolle. Es ist eindeutig zu erkennen, dass die Mutagen-Behandlung zu einer starken Zunahme der homologen Rekombination führt. Setzt man dieses Reporter-System in Mutanten ein, so lässt sich herausfinden, ob das Fehlen eines bestimmten Gens bzw. Proteins sich auf die homologe Rekombination auswirkt. Daraus lässt sich dann auf eine fördernde oder hemmende Funktion in der homologen Rekombination schließen.
Abbildung 2: MR-Assay bei Wildtyp-Pflanzen. Gezeigt sind die beiden Produkte, die nach der Meiose entstehen können. Im oberen Teil ist eine Pollentetrade ohne Entkopplung (NCO = Non-Crossover) der Marker zu sehen und im unteren Teil sieht man die entkoppelten Marker (CO = Crossover). Die Bilder zeigen jeweils eine Hellfeld-Aufnahme (DIC), eine Aufnahme mit dem jeweiligen Fluoreszenzfilter (CFP, DsRed) und ein überlagertes Bild (DIC+CFP+DsRed).