Genetische Krankheiten
Unter dem Begriff der drei „R“ der DNA werden die Prozesse zusammengefasst, die an der DNA arbeiten: Replikation, Reparatur und Rekombination.
Bei der DNA-Replikation sollen die vorhandenen Chromosomen vor der Teilung einer Zelle verdoppelt werden. Neben diesem recht bekannten Vorgang gibt es jedoch noch zwei weitere Wege. Die DNA-Reparatur umfasst viele spezialisierte Wege, um die vielfältigen Schäden an der DNA zeitnah und möglichst fehlerfrei zu reparieren. Die Rekombination von DNA hat eine große Bedeutung, wenn das Erbgut bei der Herstellung von Geschlechtszellen neu durchmischt wird. Auch bei der großen Vielfalt der Zellen unseres Immunsystems ist die DNA-Rekombination der entscheidende Prozess.
Es ist jedoch keineswegs so, dass diese drei Prozesse getrennt voneinander ablaufen. Sie sind vielmehr eng miteinander verbunden, so dass beispielsweise DNA-Schäden bereits während der Replikation repariert werden, oder dass die Reparatur von Doppelstrangbrüchen (DSBs) durch die homologe Rekombination (HR) erfolgt.
Für all diese Vorgänge müssen Basenpaarungen in der DNA vorübergehend gelöst werden – hier kommen die Helikasen ins Spiel. DNA-Helikasen sind Proteine, die an die DNA binden und sie unter Energieverbrauch entwinden. Eine besonders interessante Helikasefamilie stellen die RecQ Helikasen dar: für die Mitglieder aus dieser Familie wurden bereits zahlreiche Aufgaben in allen drei „R“ gezeigt. Zusammen mit Partnerproteinen sind RecQ Helikasen besonders involviert in die Reparatur von DSBs und verschiedene Schritte der HR. Aufgrund dessen wurden die RecQ Helikasen bereits als die „Schutzengel des Genoms“ bezeichnet.
Schwere Erbkrankheiten durch Defekte in RecQ Helikasen
Wie enorm wichtig die RecQ Helikasen für den Organismus sind, sieht man an den Krankheiten, die durch Mutationen in ihren Genen entstehen:
Ist das Gen für BLM, eine der fünf menschlichen RecQ Helikasen, mutiert, dann leiden die betroffenen Menschen am sogenannten Bloom Syndrom (BS). Neben Beeinträchtigungen der körperlichen Entwicklung haben die Patienten eine gegenüber der gesunden Bevölkerung stark erhöhte Krebsrate. BLM unterdrückt normalerweise im Zellkern eine unerwünscht hohe HR-Rate und wird benötigt für die Reparatur von verschiedenen Schäden der DNA. Fällt dieses Protein nun aus, dann häufen sich in den Zellen der BS-Patienten sehr schnell viele Schäden an, die fehlerhaft repariert werden oder sogar unrepariert bleiben. So entwickeln sich schon sehr früh Tumore, die insgesamt eine stark verringerte Lebenserwartung zur Folge haben.

Abbildung 1: Das Werner Syndrom beim Menschen. Von der Jugend an altern Menschen, die unter dem Werner Syndrom leiden, schneller als gesunde Menschen. Dies zeigen Bilder einer japanstämmigen WS-Patientin (oben) mit 15 und 48 Jahren und auch einer zweiten Patientin (unten) mit 8 und 36 Jahren besonders deutlich – bereits im mittleren Alter tragen WS-Patienten klinische Merkmale der Alterung, die normalerweise erst sehr viel später entstehen. (Bildquelle: Muftuoglu et al. (2008), Hum Genet 124(4) via http://www.springerimages.com)
Auch beim Werner Syndrom (WS), das auf Mutationen im Gen der RecQ Helikase WRN zurückzuführen ist, wurde eine erhöhte Krebsrate beobachtet. Viel auffälliger ist hier jedoch etwas anderes: Das WS ist eine sogenannte Progerie-Erkrankung, also eine Krankheit bei der die Patienten schneller altern. Etwa ab der Pubertät treten bei WS-Patienten erste Symptome auf, und bereits im mittleren Alter zeigen diese klinische Merkmale von sehr viel älteren Menschen wie etwa grauen Star, Diabetes und Osteoporose. Dies ist wohl vor allem darauf zurückzuführen, dass WRN eine wichtige Rolle im Erhalt der Enden von Chromosomen, den Telomeren, spielt. Über ein Menschenleben verkürzen sich diese immer weiter bei jeder Zellteilung; fällt das WRN Gen aus, läuft dieser Prozess sehr viel schneller ab, als dies normalerweise der Fall ist – die Patienten altern schneller.

Abbildung 2: Werden Gene ausgeschaltet, die für die DNA-Reparatur benötigt werden, dann reagieren diese Mutanten sensitiver auf DNA-schädigende Substanzen: Während der unveränderte Wildtyp (oben) fast nicht auf die von links nach rechts ansteigende Konzentration eines Genotoxins reagiert, ist nach Ausfall einer RecQ Helikase (unten) eine starke Einschränkung des Wachstums aufgrund starker Schäden an der DNA festzustellen.
Schnelle Evolution in entgegengesetzte Richtungen
Die RecQ Helikasen sind für uns aber auch aus einem weiteren Grund spannend: Bei den Pflanzen sind mit Hilfe von bioinformatischen Methoden mindestens 8 verschiedene RecQ Gene zu finden, 7 davon in unserem Modellorganismus Arabidopsis thaliana (Ackerschmalwand).
Zwei dieser Gene, RECQ4A und RECQ4B, sind erst innerhalb der Familie der Kreuzblütengewächse (Brassicaceae) durch eine Duplikation eines größeren Bereichs eines Chromosoms entstanden. In evolutionären Zeiträumen ist das sehr kurz: Die Duplikation erfolgte vor weniger als 40 Millionen Jahren. Dementsprechend ähnlich sind sich die Proteinsequenzen von RECQ4A und RECQ4B; rund 70 % ihrer Aminosäuren sind identisch. Es war für uns darum eine große Überraschung als wir feststellten, dass diese beiden Gene in der Zelle gegensätzliche Aufgaben haben! RECQ4A spielt eine wichtige Rolle in verschiedenen DNA-Reparaturwegen und unterdrückt die homologe Rekombination. Es ist darum dem menschlichen BLM-Protein und zahlreichen weiteren RecQ Helikasen aus anderen Organismen sehr ähnlich. RECQ4B dagegen spielt wahrscheinlich keine Rolle in der DNA-Reparatur, fördert jedoch die HR. Es ist bisher tatsächlich noch in keinem anderen Organismus eine RecQ Helikase bekannt, die eine fördernde Wirkung auf die homologe Rekombination hat.
Wir wollen deshalb beispielsweise herausfinden, welche Aufgaben der Vorläufer von RECQ4A und RECQ4B (die ja nur innerhalb der Familie der Brassicaceen vorkommen) in anderen Pflanzen wahrnimmt – ist es eine Mischung der beiden Gene, oder sind manche Funktionen erst nach der Genduplikation neu entstanden?
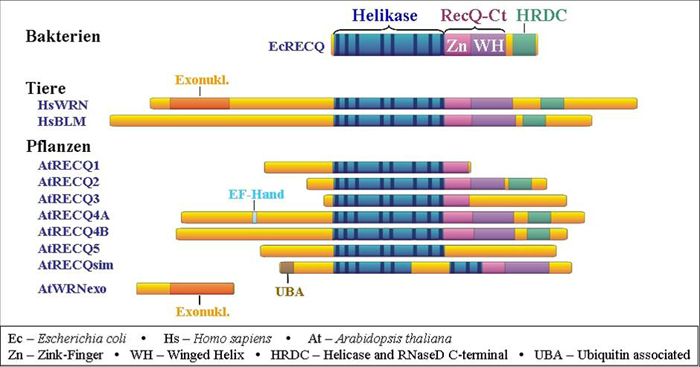
Abbildung 3: RecQ Helikasen besitzen auch in verschiedenen Organismen einen vergleichbaren Aufbau. Die für die Funktion des Proteins wichtigen Abschnitte, Domänen genannt, lassen sich zunächst bioinformatisch identifizieren. Anschließend können die Funktionen dieser Domänen analysiert werden, indem man genetisch oder biochemisch den Ausfall einzelner Domänen untersucht.
Die Familie der RecQ Helikasen ist also ein sehr spannendes Forschungsthema, weil wir daran sehr verschiedene Fragestellungen untersuchen können. Letztlich haben wir hier sogar die Möglichkeit, an medizinischen Problemen der Grundlagenforschung aus einer anderen Richtung mitzuarbeiten. Wie auch bei den Brustkrebsgenen erklärt sind Säugetiere oft nicht lebensfähig, wenn man viele dieser Gene ausschaltet. Eine Untersuchung in Mäusen ist dann nicht möglich, während wir in Arabidopsis Antworten erhalten können.

