 |
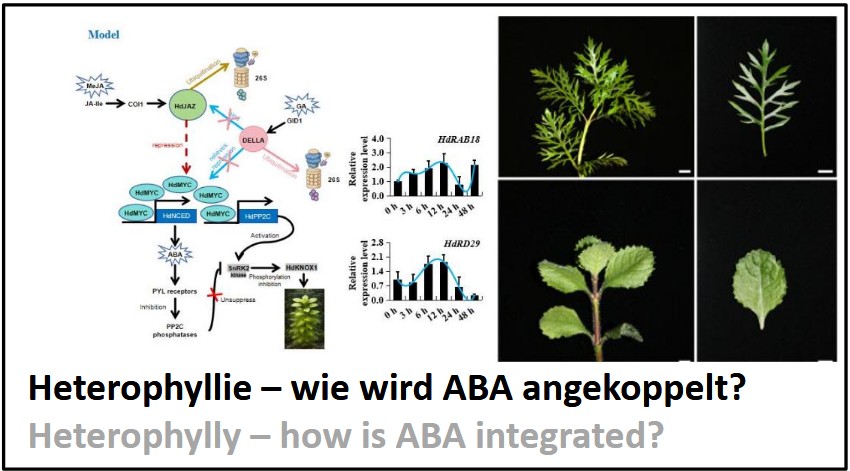
Plant Cell Biology 2026Look at the picture and can you believe that both plants belong to the same species? Yes, this is a classic example of extreme adaptation to changing environments, a fascinating phenomenon called “heterophylly”. The picture shows submerged (top) and emerged (bottom) leaves of an amphibious plant that can produce differently shaped leaves, depending on whether it is grown underwater or outside of water. In nature, many diverse classes of plants exhibit heterophylly. The crucial question here is: What are the molecular mechanisms that govern heterophylly? To answer this, we are using Hygrophila difformis. Ongoing work in the team of Dr. Jathish Ponnu hints towards the role of blue light in mediating the “developmental switch” in Hygrophila. Plants perceive blue light via the flavoproteins called cryptochromes. At some point, these sensory inputs need to be translated into developmental processes. Previous research by Xiao Chen, a PhD student in the lab, showed a crucial role for jasmonates. For instance, exogenous Methyl-Jasmonate can induce terrestrial leaves even when the plants are submerged. At a final stage, the transcription factor KNOX, known to control leaf shape, is thought to be modulated. But what is in-between? To shed light into the tunnel between jasmonate signalling and KNOX regulation is the task of this project. Since jasmonate-dependent transcription factors are also recruited for ABA responses, Xiao Chen has developed a working model, where ABA signalling is recruited for heterophylly. This hypothesis can serve a blueprint to ask specific questions that can be addressed experimentally, for instance by verifying in-vitro and in-planta physical interaction of protein candidates, by measuring DNA-binding using gel-mobility shift assays, or by measuring phosphorylation activities. For more information, refer to the script provided in Ilias. |
||
Self Organisation of Plant Cells
What is our motivation? Part and Entity.
In plants, the relation between parts and entity differs fundamentally. All cells are more or less autonomous, there are no preformed hierarchies, and in principle, each individual cell can generate an entire organism. To translate this into medical terms: each plant cell can act as a stem cell. How can these "cells without big boss" avoid chaos? Obviously, these cells are very skilled in democratic organisation. That is, what we want to understand. Since plant embryos are enclosed in maternal tissue and therefore difficult to be observed, we have developed cellular models. We were able to show that the widely used tobacco cell line BY-2 can generate files of 6-10 cells that behave like a minimal organism. The cells in this file do not divide randomly, but synchronise their divisions with their neighbours. Our research demonstrated that the individual cells generate chemical oscillations that will, by a kind of resonance, create a common rhythm for the entire cell file. This rhythm is produced by the targeted efflux of auxin and the response of actin to this auxin pulse. Actin filaments, the cellular muscles, relax, when they sense auxin, and they contract when auxin is depleted. The activity of actin controls the the transport of auxin pumps to their site of action, at the cell membrane. This will establish an oscillatory circuit, which to our opinion, is the core element of self organisation in plants.
What did we find?
- To understand the actin-auxin oscillator, we have to understand, which processes mediate the response of actin filaments to auxin. Since actin is a conservative protein, we think that this response depends on proteins associated with actin. The fact that actin responds to auxin does not mean that actin is used to sense auxin. We are therefore also working on experimental approaches to find out, whether actin is indeed a sensor. more...
- A daughter cell not only inherits the genes from the mother, it also gets a directional imprent, a "direction", which is outside of the genes. To investigate this, we have developed a tabula rasa system, where plant cells are stripped from their directionality, such that we can observe, how a new direction is generated de novo. more...
- During our work with the tabula rasa system, we were able to see that the cell is using cues from the environment to explore the space around. In a tissue context, this allows to adjust the innate directionality with the neighbours in a way that will minimise the tension in a plant tissue. more...
- When plant cells sense geometry, the nucleus wanders around until it finally finds the cell center. This movement depends on a specific actin basket that squeezes the nucleus in a peristaltic manner. Using superresolution microscopy, we were able to see this movement at a precedented resolution of only 20 nm. more...
Tabula rasa. In einem pflanzlichen Gewebe bekommt jede Tochterzelle von ihrer Mutter nicht nur die Gene mit auf den Weg. Ähnlich wie eine russische Matrjoschka-Puppe vererbt die Mutterzelle auch ihre "Richtung", ihre Ordnung und Architektur. Wir haben nun verstanden, dass die Richtung der Zelle für die Selbstorganisation wichtig ist (die chemischen Schwingungen entstehen ja durch einen gerichteten Fluss des Pflanzenhormons Auxin durch den Zellfaden). Im nächsten Schritt müssen wir verstehen, wie "Richtung" neu entsteht. Dazu müssen wir die "Richtung" erst einmal entfernen, also reinen Tisch machen, um dann beobachten zu können, wie eine solche "richtungslose" Zelle von dieser tabula rasa ausgehend eine neue "Richtung" aufbaut. Nach vielen vergeblichen Anläufen ist es uns nun gelungen, durch Abverdau der Zellwand, solche richtungslosen Zellen zu entwickeln und sie dazu zu bringen, eine neue Richtung aufzubauen. Mithilfe von gentechnisch veränderten Linien, bei denen das Zellskelett über leuchtende Proteine aus Meeresquallen (Grün Fluoreszente Proteine) markiert ist, können wir nun beobachten, wie sich Actinfilamente und Mikrotubuli beim Aufbau einer neuen Zellrichtung verhalten. Ausserdem können wir prüfen, was passiert, wenn wir über chemische und gentechnische Manipulation der Aufbau und die Dynamik des Zellskeletts verändert wird. Aus diesem tabula rasa System haben wir gelernt, dass am Anfang der Zellkern erst einmal die Mitte der Zelle sucht. Wenn er die Mitte gefunden hat und dort über das Zellskelett verankert wird, bildet sich erst einmal eine neue Zellwand, die aber noch vollkommen symmetrisch ist. Im nächsten Schritt bilden die Actinfilamente ein Gefälle aus und bilden eine äußerlich noch nicht sichtbare "Spitze" aus. Danach richten sich die Mikrotubuli senkrecht zu dieser "Richtung" aus und organisieren nun die Cellulosefasern der Zellwand in derselben Orientierung. Dadurch wird die Zellwand in der einen Richtung dehnbarer und die Zelle beginnt sich wurstartig in der neuen "Richtung" zu strecken. Einen halben Tag später beobachtet man schon die ersten Zellteilungen, die strikt durch die neue "Richtung" kontrolliert sind. Ein neuer Minimalorganismus ist entstanden.
Wie wird Geometrie gemessen? In einem Pflanzengewebe müssen die "Richtungen" der Einzelzellen aufeinander abgestimmt werden, um so mechanische Belastungen beim Wachstum zu vermeiden. Gleichzeitig können die Einzelzellen über Messung der mechanischen Spannung im Gewebe feststellen, was die anderen Zellen tun. Beispielsweise hat man herausgefunden, dass die Blattstellung in der Spross-Spitze auf diese Weise gesteuert wird, ohne dass eine übergeordnete Instanz den Einzelzellen sagt, in welche Richtung sie sich teilen oder sich ausdehnen sollen. Es scheint also so zu sein, dass "Richtung" über mechanische Signale aus der Umgebung entsteht. Das ist aber nur die halbe Wahrheit - die Zellen eines Gewebes sind nämlich auch chemisch miteinander gekoppelt, zum Beispiel über einen gerichteten Fluss des Pflanzenhormons Auxin (ähnlich wie in unserem Minimalorganismus). Es wäre für ein Gewebe auch nicht sehr zielführend, wenn erst einmal heftige mechanische Spannungen aufgebaut werden, und danach alle Zellen sich noch mal neu anordnen müssten. Raffinierter wäre es doch, wenn die Einzelzellen ihre "Richtung" schon von vorneherein so festlegen könnten, dass gar nicht erst große Spannungen entstehen können. Wir haben nun unser tabula rasa System dafür genutzt, um die Frage zu klären, wie Pflanzenzellen die Geometrie ihrer Umgebung messen. In einer Kooperation mit dem National Institute for Nanotechnology in Beijing haben wir eine mikrofluische Kammer entwickelt, wo die wandlos gemachten Einzelzellen in kleine Töpfchen eingefügt werden können. Jedes Töpfchen hat in etwa Größe und Form einer ausgewachsenen Pflanzenzelle. Nach etwas Anfangswehen gelang es uns, die richtungslos gemachten Zellen in diesem System zu kultivieren, zu beobachten und über einen mikrofluidischen Strom von Auxin oder Auxintransport-Hemmstoffen einen chemischen Gradienten aufzuprägen. Wir stellten überrascht fest, dass die Zelle ihre Richtung vorzugsweise in der langen Achse des rechteckigen Töpfchens orientieren. Noch überraschter waren wir, als wir feststellten, dass die Zelle ihre "Richtung" schon zeigt, bevor sie die Wand des Töpfchens überhaupt berührt hat. Woher "weiss" sie denn, wo die Wand ist? Ein Experiment mit einem Hemmstoff des Auxintransports brachte die Antwort. Nach Behandlung dieses Hemmstoffs können die Zellen nämlich nicht mehr feststellen, wie die Geometrie des Töpfchens aussieht, so dass viele Zelle falsch orientiert sind und sich querstellen. Offenbar pumpen diese Zellen also Auxin in ihre Umgebung und prüfen, ob sich dieses anhäuft (dann ist da kein Platz) oder ob es verschwindet (dann ist da Platz). Im nächsten Schritt entsteht ihre "Richtung" dann so, dass die Zelle sich später dorthin ausdehnt und auch teilt, wo Platz ist. Auf diese Weise wird verhindert, dass in einem Gewebe schädliche mechanische Spannungen entstehen. Zur Probe aufs Exempel haben wir dann die Zellen mit zwei widersprüchlichen Reizen konfrontiert - dazu wurde ein Gefälle von Auxin senkrecht zur Geometrie des Töpfchens eingestellt. Je nach Stärke des Auxingradienten entschieden sich die Zellen dann für den chemischen oder für den geometrischen Reiz.
Kernwanderung jenseits der Auflösungsgrenze. Aus unseren tabula rasa Experimenten wissen wir, dass der Zellkern eine entscheidende Rolle bei der Richtungsbildung spielt. Erst muss er die Mitte der Zelle finden, bevor sich von dort aus eine neue "Richtung" bilden kann. Deshalb wird derzeit die Kernwanderung intensiv beforscht. Der Zellkern einer Pflanzenzelle liegt nicht einfach so herum, sondern ist durch das Zellskelett aufgehängt und wird, vor allem vor der Zellteilung, gezielt an die Stelle gebracht, wo danach die Ebene der Teilung sein wird. Wir konnten schon einige der molekularen Mitspieler bei diesem Geschehen aufklären - neben einem nur bei Pflanzen vorkommenden Kinesinmotor ist das ein spezieller Käfig aus Actinfilamenten, der den Kern förmlich einspinnt und bei der Bewegung des Kerns vor allem die Luvseite markiert. Wie die Bewegung funktioniert, ist freilich noch unverstanden. Um das verstehen zu können, müssen wir das Verhalten dieses Actinkäfigs genauer sehen, als das mit dem Lichtmikroskop sonst möglich ist. Bedingt durch die Wellenlänge des Lichts (etwa 500 nm) lassen sich Strukturen, die kleiner sind als eine Lichtwellenlänge, nicht mehr auflösen. Diese magische Auflösungsgrenze ist in den letzten Jahren durch neue Entwicklungen in der Mikroskopie gebrochen worden. Man kann nämlich schaltbare fluoreszente Sonden einsetzen und schaltet dann immer nur ganz wenige davon an, so dass man jedem Lichtfleck ein Molekül zuordnen kann. Der Platz dieses Moleküls lässt sich dann über komplexe Rechenverfahren ganz genau bestimmen. Dann schaltet man die Moleküle wieder aus und aktiviert den nächsten Satz von fluoreszenten Sonden. Das Ganze wird so lange wiederholt, bis die ganze Zelle mit genau bestimmten Lichtpunkten gepflastert ist. Mit diesem PALM genannten Verfahren kann man dann auf 20 nm Auflösung kommen, was 10-20 mal feiner ist als alles, was man bisher hinbekommen hat. In Kooperation mit der Arbeitsgruppe von Prof. Dr. Uli Nienhaus in der Biophysik konnten wir zum ersten Mal die PALM Technik auf Pflanzenzellen anwenden und damit den Actinkäfig in sogenannter Super-Auflösung sichtbar machen. Dies brachte überraschende Erkenntnisse über die Art, wie der Zellkern bewegt wird - er scheint nämlich nicht gezogen, sondern eher peristaltisch durch die Zelle "gequetscht" zu werden. Jetzt wollen wir verstehen, wie die "Richtung" dieser Bewegung entsteht - denn die Richtung der Kernbewegung scheint die Wurzel für die "Richtung" der gesamten Zelle zu sein. Wir landen also immer mehr bei einer Sichtweise, wo die Architektur von Pflanzenzelle und Organismus auf gerichtete Bewegungen zurückgeführt werden kann. Die uns sichtbare Gestalt einer Pflanze ist also nichts anderes als verfestigte Spur innerzellulärer Bewegung...
