Wer steuert die Muskeln der Pflanzenzelle?
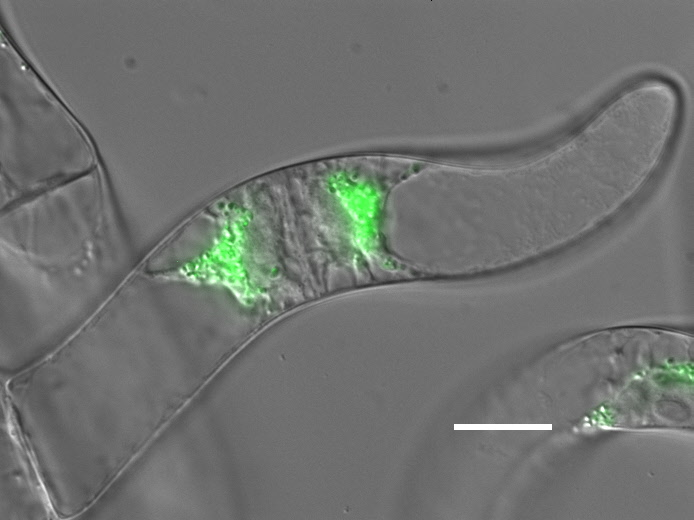
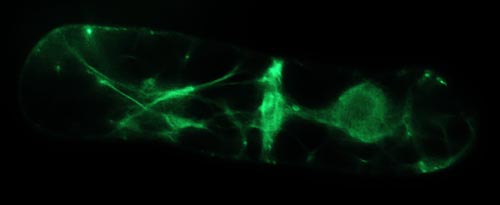
Actinbindeproteine steuern die Bündelung und die Organisation von Actinfilamenten, den Muskeln der Pflanzenzelle. Man wundert sich vielleicht, wozu Pflanzenzellen Muskeln besitzen, wenn sie ja doch nicht davonlaufen können. Das haben wir uns auch gefragt und im Laufe der vergangenen 15 Jahre nach Funktionen pflanzlicher Actinfilamente gesucht. Dabei fanden wir heraus, dass pflanzliches Actin eine große Rolle bei der innerzellulären Bewegung spielt. Diese Bewegungen sind Teil der unglaublichen Anpassungsfähigkeit von Pflanzen, die sich ja an ihre jeweilige Umwelt anpassen müssen, weil sie eben nicht wegrennen können. Pflanzliche Zellen sind daher fortwährend damit beschäftigt, ihre Richtung in Bezug auf die Umwelt zu überprüfen und neu auszurichten. Als Signal dient ihnen dabei das Pflanzenhormon Auxin, das in einem beständigen Strom von der Spitze der Pflanze bis zur Wurzel fliesst. Unsere Arbeiten haben gezeigt, dass pflanzliches Actin an der Wahrnehmung und Aufrechterhaltung dieses Auxinstroms beteiligt ist. Dabei wird die Kontraktion der "Muskelfasern" abhängig von Auxin verändert (ähnlich wie wir unsere Muskeln abhängig von Nervensignalen anspannen oder lockern). Wir wollen nun verstehen, wie Auxin die Bündelung von Actin steuern kann und haben daher eine Reihe von Actinbindeproteinen isoliert und kloniert.
Thema: Im Rahmen des Projekts soll ein neuentdecktes Actinbindeprotein, ein sogenanntes Formin, untersucht werden. Dabei soll eine schon vorhandene Fusion dieses Formins mit GFP in Tabak-BY-2 Zellen exprimiert werden. Uns interessiert dabei, wo dieses Protein in der Zelle zu finden ist, wie sich die Actinfilamente verändern, wenn dieses Protein überexprimiert wird und wie diese Effekte von Auxin abhängen. Dazu wird ein neues Verfahren der transienten Transformation eingesetzt, das sehr hohe Ausbeuten liefert, so dass man sehr viel über die zellbiologische Funktion des Formins lernen kann. Gleichzeitig soll versucht werden, eine stabile Tabaklinie zu etablieren, so dass auch die Auswirkung auf die Entwicklung (z.B. Musterbildung) untersucht werden kann. Unsere Kooperationspartner in Korea haben das Formin-GFP in Reis eintransformiert, so dass man Lokalisation un Funktion auch an "richtigen" Pflanzen studieren kann. Methodisch kommen vor allem fluoreszenzmikroskopische und molekularbiologische Techniken zum Einsatz.
Hintergrundinformationen zum Projekt
[26] Nick, P. (2010) Probing the actin-auxin oscillator. Plant Signaling and Behaviour 5, 4-9 - pdf - (kurze Zusammenfassung unserer Arbeiten zum pflanzlichen Actin und zu unserem Modell für seine Funktion)
74. Nick, P., Han, M., An, G. Auxin stimulates its own transport by actin reorganization. Plant Physiology 151, 155-167 - pdf - (selected for the Faculty of 1000, 21.10.2009) - (hier wird an "richtigen" Pflanzen (Reis) gezeigt, dass Auxin seinen eigenen Fluss durch die Pflanze über Actin steuern kann)
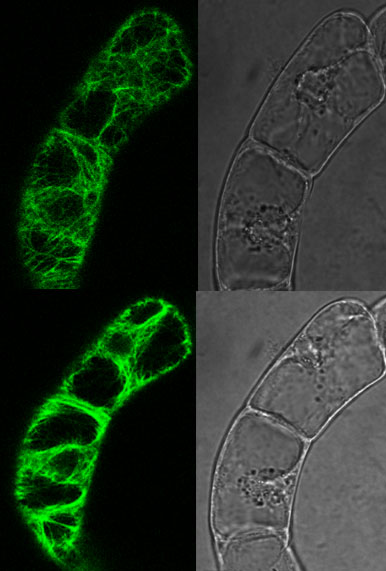
Wie sich anarchische Pflanzenzellen selber organisieren...
Biologische Frage: Was ist Musterbildung und was ist daran interessant?
Die Erfindung der Vielzelligkeit war ein grosser Schritt in der Evolution. Vielzelligkeit erlaubt Arbeitsteilung - unterschiedliche Zellen können sich auf unterschiedliche Funktionen spezialisieren und das ist von Vorteil für die ganze Gemeinschaft. Aber dies setzt voraus, dass die Zuordnung der verschiedenen Funktionen organisiert und gesteuert werden muss. Dies könnte über eine Chefzentrale geschehen, die den anderen Zellen übergeordnet ist. Pflanzen sind jedoch geradezu "urdemokratisch" gebaut. Jede Zelle ist im Grunde gleichberechtigt - beispielsweise kann jede Zelle einen ganzen Organismus hervorbringen, wenn sie aus dem Gewebe herausgetrennt und entsprechend kultiviert wird. Muster sind Gebilde, die auf der Ebene des Ganzen entstehen, dadurch, dass die Einzelelemente in geordneter Weise voneinander unterschieden sind. Das Spannende bei der pflanzlichen Musterbildung ist nun, dass gleichberechtigte Elemente, die weitgehend autonom sind, sich zu einem geordneten Ganzen zusammenfügen und dies ohne einen "Big Boss", der alles steuert.
Unser Ansatzpunkt: Auxin - der grosse Kommunikator
Auxin ist ein sehr einfaches Molekül, aber es hat sich schon sehr früh in der Evolution zu einem zentralen Werkzeug der pflanzlichen Musterbildung entwickelt. Es wird in einem gerichteten Fluss über das Gewebe hinweg transportiert. Dieser Auxinfluss ist für die klare Ausrichtung der Pflanzen entlang der Spross-Wurzel-Achse verantwortlich. Das war schon lange bekannt. Unsere Forschungen zeigen nun, dass Auxin nicht nur die Richtung vorgibt, sondern auch die Teilung benachbarter Zellen in Takt hält. Über Auxin werden also die eigentlich eher anarchischen Pflanzenzellen zu einer Ganzheit zusammengefügt. Uns interessieren dabei nicht nur die molekularen Grundlagen dieses Musterbildungsprozesses. Besonders spannend ist für uns dabei die Frage, nach welchen Gesetzen das autonome Verhalten der einzelnen Zelle durch Signale ihrer Nachbarinnen harmonisiert wird. In Zusammenarbeit mit japanischen Chemikern konnten wir mithilfe eines durch Licht schaltbaren Auxins das musterbildende Signal gezielt manipulieren. Gemeinsam mit der Arbeitsgruppe von Prof. Dr. Jahnke aus der Angewandten Mathematik wird derzeit an der Modellierung der Musterbildung gearbeitet.
Thema der Arbeit
Wir wollen an diesem Beispiel eines noch recht einfachen Minimalorganismus ein Kernproblem der Entwicklungsbiologie verstehen, wie aus einer einzelnen Zelle ein Ganzes entsteht. Neben dem Signal (Auxin) ist hier die Richtung der Zellen entscheidend. Die hängt eng mit dem Actinskelett zusammen. In dem Bachelorprojekt "Was steuert die Muskeln der Pflanzenzelle" geht es um die Proteine, die am Actin sitzen und dessen Organisation steuern, in diesem Projekt soll gemeinsam mit den Kollegen in der Mathematik ein quantitativer Ansatz erarbeitet werden. Das heisst nicht, dass man selber mathematisch modellieren muss, man muss aber fähig sein, einem Mathematiker zu erklären, wie eine pflanzliche Zelle funktioniert und Fragen des Mathematikers an das System so in Biologie zu "übersetzen", dass daraus ein Experiment entsteht, dass diese Frage beantwortet. Neben Fluoreszenzmikroskopie kommen daher vor allem auch manipulative zellbiologische Techniken zum Einsatz.
Hintergrundinformationen zum Projekt
[26] Nick, P. (2010) Probing the actin-auxin oscillator. Plant Signaling and Behaviour 5, 4-9 - pdf - (kurze Zusammenfassung unserer Arbeiten zu Auxin, Actin und zur Musterbildung.
Projekt 4: Chemical Engineering mit Trojanischen Pferden
Biologische Frage: Signalverarbeitung durch Veränderung der Architektur?
Zellen müssen auf zahlreiche und unterschiedliche Signale der Außenwelt reagieren können, um zu überleben. Diese Signalverarbeitung wird üblicherweise mit dem An- oder Abschalten von Genen oder der Veränderung von Proteinaktivitäten (z.B. über Phosphorylierung) erklärt. Vor allem bei Pflanzenzellen ist jedoch inzwischen ein dritter Weg der Signalverarbeitung aufgetaucht. Dieser beruht auf Veränderungen der zellulären Architektur. Beispielsweise wird die Achse des Wachstums durch eine Umrichtung der corticalen Mikrotubuli bewirkt, die als Leitschienen für die Bewegung von Enzymen fungieren, die Cellulose synthetisieren. Durch die Richtungsänderung der Mikrotubuli ändert die Zellwand daher ihre mechanischen Eigenschaften und wird in einer bestimmten Richtung dehnbarer, so dass die Zelle sich dann in diese Richtung ausdehnt. Will man solche Änderunen der Architektur verstehen, genügt es nicht, über gentechnische Verfahren (Genetic Engineering) bestimmte Genprodukte an- oder abzuschalten, man muss zusätzlich das räumliche Muster dieser Genprodukte innerhalb der Zelle verändern.
Unser Ansatzpunkt: Chemical Engineering mit nanobiologischen Verfahren
Chemical Engineering ist jünger als das in der modernen Biologie weit verbreitete Genetic Engineering. Man benutzt dabei chemische Werkzeuge, um biologische Systeme gezielt zu manipulieren. Dazu zählen auch neuartige Materialien, die aufgrund ihrer winzigen Größe (man spricht von Nanowissenschaften) spannende und oft unerwartete Eigenschaften besitzen. Ein Knackpunkt beim Einsatz solcher nanobiologischer Verfahren ist die Zellmembran - so klein diese Nanopartikel auch sind, so werden sie doch von der Zellmembran ausgeschlossen. Natürlich könnte man künstliche Löcher in die Zellmembran einbringen, doch dabei würden die Zellen augenblicklich sterben. Gemeinsam mit Chemikern und Materialwissenschaftlern des Centers for Functional Nanosciences suchen wir daher nach Schleichwegen, um große Moleküle oder Partikel in lebende Pflanzenzellen einzuschleusen ohne die Membran zerstören zu müssen. In der Tat konnten wir inzwischen einige "Trojanische Pferde" finden, die fluoreszent markierte Frachten in lebende Tabakzellen einschmuggeln können und sogar gezielt an bestimmte Ziele (Mitochondrien, Actinfilamente) gelenkt werden können.
Thema 1: Unsere Partner in der Chemie waren nicht untätig und haben inzwischen weitere Vehikel entwickelt, die möglicherweise noch größere Frachten transportieren können. Diese müssen nun auf ihre Eignung überprüft werden. Geeignete Kandidaten werden dann weiterentwickelt und mit interessanten Frachten gekoppelt, um spezifisch zelluläre Vorgänge verändern zu können. Dieses Projekt umfasst fluoreszenzmikroskopische Verfahren, neben Apotomie und Konfokalmikroskopie auch spinning disc und STED Mikroskopie. Objekte sind Tabakzellkulturen, bei denen verschiedene Zellbestandteile (Cytoskelett, Vesikel, Membranen) durch fluoreszente Proteine markiert sind. Unter anderem geht es auch darum, zu verstehen, wie das Einschleusen funktioniert - wir wissen schon, dass es keine Endocytose ist, der Mechanismus ist jedoch noch ziemlich unerforscht.
Thema 2: Wir wollen die schon etablierten Transporter dafür einsetzen, nicht nur fluoreszente Moleküle einzuschleusen, sondern Frachten, die es uns erlauben, zelluläre Vorgänge gezielt an- oder abzuschalten. Diese von unseren Kooperationspartnern synthetisierten Frachten umfassen Nanopartikel, die bei Belichtung reaktive Sauerstoffspezies produzieren (zentrale Signalmoleküle bei der zellulären Antwort auf Krankheitserreger) aber auch Peptidmotive, die mit innerzellulären Bindestellen konkurrieren (dies ein ganz neuer von uns entworfener Ansatz mit viel Potential). Auch bei diesem Projekt kommen die oben erwähnten fluoreszenzmikroskopischen Verfahren und die fluoreszent markierten Tabakzelllkulturen zum Einsatz.
Hintergrundinformationen zu diesem Projekt
[30] Eggenberger, K., Frey, N., Zienicke, B., Siebenbrock, J., Schunck, T., Fischer, R., Bräse, S., Birtalan, E., Nann, T., Nick, P. (2010) Use of nanoparticles to study and manipulate plant cells, Adv. Biomat. 12, 406-412 - pdf - Zusammenfassende Darstellung unserer Arbeiten zur Nanobiologie
72. Eggenberger, K., Schröder, T., Birtalan, E., Bräse, S., Nick, P. (2009) Passage of Trojan Peptides into Plant Cells. ChemBioChem 10, 2504 – 2512 - pdf - Zum ersten Mal ist es gelungen, Trojanische Peptoide in Pflanzenzellen einzuschleusen.
Projekt 5: Cytoskelett als "Sinnesorgan" der pflanzlichen Immunität?
Biologische Frage – Wie und wozu wandert der Kern bei der pflanzlichen Abwehr?
Pflanzenzellen können sich ebenso wie Tier und Mensch gegen eine Vielzahl von Krankheiten zur Wehr setzen und bedienen sich dabei einer früh in der Evolution entstandenen Form von Immunität. Diese innate immunity kann über eine Reihe von mikrobiellen Proteinen (z.B. Flagellin, einem Baustein bakterieller Geißeln) ausgelöst werden und münden letztlich im Anschalten von Abwehrgenen, deren Produkte (sogenannte Phytoalexine) den Eindringling bekämpfen. Man kennt auch schon einige der Rezeptoren, die zum Beispiel Flagellin oder andere „Alarmsignale“ (sogenannte Elicitoren) binden und dann eine Signalkette auslösen, die von der Membran zum Zellkern läuft. Viele Schritte dazwischen sind noch nicht verstanden, nicht wirklich verstanden sind auch die zellulären Antworten der innate immunity. Beispielsweise wandert der Zellkern auf die Stelle zu, wo der Erreger versucht, in die Zelle einzudringen, das Cytoskelett wird umorganisiert und lenkt Vesikel mit Abwehrstoffen auf den Eindringling hin. Woher „wissen“ Kern und Cytoskelett, in welcher Richtung sie sich neu orientieren müssen?
Unser Ansatzpunkt – Signalverarbeitung durch Mikrotubuli
An zwei Zell-Linien von Weinreben, die sich in ihrer Anfälligkeit gegenüber dem Falschen Mehltau unterscheiden, konnten wir zeigen, dass das Cytoskelett nicht nur passiv, gleichsam als „Opfer“ der Immunität, umorganisiert wird, sondern dass die Mikrotubuli ganz früh in der Signalkette mitmischen. Durch Manipulation der Mikrotubuli mit Hemmstoffen konnten wir Abwehrgenen anschalten, obwohl gar kein Elicitor vorhanden war. Wir vermuten daher, dass die Mikrotubuli als eine Art Gestänge die Ionenkanäle steuern, die in Antwort auf Elicitoren geöffnet werden.
Projekt
Im nächsten Schritt geht es darum, dieses Modell mit Fleisch zu füllen. Können wir die Reaktion der Mikrotubuli auf Elicitoren an der Membran sichtbar machen? Können wir mithilfe von schaltbaren Steuerproteinen des Cytoskeletts die Immunität kontrollieren? Neben fluoreszenzmikroskopischen Techniken wie TIRF-Mikroskopie kommen auch klassische Methoden der Phytopathologie, Genexpressionsstudien, aber auch HPLC-basierte Messungen von Phytoalexinen (wie z.B. Resveratrol) zum Einsatz. Neben den oben erwähnten Vitis-Zell-Linien werden für in-vivo Studien auch fluoreszent markierte Tabakzell-Linien untersucht. Je nach Interesse sollen auch neue Linien erzeugt werden, bei denen Promotoren von Abwehrgenen vor einen Reporter (GFP, Timer-GFP) geschaltet ist, so dass das Anschalten von Immunitätsgenen auch in lebenden Zellen beobachtet werden kann.
Hintergrundinformationen zu diesem Projekt
80. Qiao, F., Chang, X., Nick, P. The cytoskeleton enhances gene expression in the response to the Harpin elicitor in grapevine. J. Exp. Bot. 61, 4021–4031 - pdf (hier wird zum ersten Mal beschrieben, dass Mikrotubuli eine sensorische Funktion bei der pflanzlichen Abwehr ausüben.)
Projekt 6: Gift oder Medizin? Molekulare Zellbiologie und Identifizierung in der Traditionellen Chinesischen Medizin
Biologische Frage: Identifizierung von Pflanzen der Traditionellen Chinesischen Medizin
Seit einigen Jahren werden Präparate der Traditionellen Chinesischen Medizin (TCM) auch in Europa immer populärer. Dies stellt die Behörden vor große Probleme; denn die die überwiegend pflanzlichen Produkte sind nicht nach den in Europa üblichen Standards identifiziert. In der Tat ist dies bei TCM-Produkten oft schwierig, da diese üblicherweise als Mischungen getrockneter Pflanzenteile vertrieben werden. Zudem fehlen oft die hier in Europa üblichen mikroskopischen Monographien und Beschreibungen. Durch Zweideutigkeiten bei der Umsetzung von Schriftzeichen in Pinyin-Umschrift und dann weiter in einen lateinischen Artnamen kommt es zu zusätzlichen Unklarheiten. Und dann gibt es eine ganze Reihe von Arten, die ähnlich aussehen, aber nicht medizinisch wirksam, in manchen Fällen sogar schädlich sind. Beispielsweise kann han fangji (Stephania tetranda) mit der giftigen guang fanji (Aristolochia fanchi) verwechselt werden. Vor einigen Jahren führte dies in Belgien dazu, dass zahlreiche Patienten Nierenversagen erlitten und seither auf Dialyse angewiesen sind.
Unser Ansatzpunkt: Genetic Barcoding und Zellbiologische Analyse
Seit einiger Zeit haben wir damit begonnen, traditionelle Methoden der Identifizierung von Nutzpflanzen (lichtmikroskopische Analyse) mit molekularbiologischen Markern (Genetic Barcoding) zu kombinieren und daraus praktikable Diagnoseverfahren zu entwickeln. Wir haben dies modellhaft an einer in der ayurvedischen Medizin genutzten Pflanze (dem Heiligen Basilikum ‚Tulsi’) demonstriert und konnten zeigen, dass zahlreiche Handelspräparate gar nicht ‚Tulsi’, sondern schlicht einfach nur Küchenbasilikum enthielten. In Zusammenarbeit mit der Firma Phytocomm in Kehl (dem größten Importeur für TCM-Pflanzen) haben wir damit begonnen, im Botanischen Garten des KIT eine Lebendkollektion von TCM-Pflanzen aufzubauen, deren Herkunft zertifiziert ist. Für diese Pflanzen werden derzeit genetic barcodes erstellt.
Projekt: Auf der Basis der genetic barcodes sollen nun im Rahmen des Projekts für ausgewählte Arten PCR-basierte Nachweistests zu entwickeln, mit denen die Identifizierung einer Art in einer Probe schnell und sicher möglich ist. Vor allem kann man damit auch toxische Surrogatarten ausschliessen und so die TCM sicherer machen. Parallel dazu sollen für diese Arten zellbiologische Monographien entwickelt werden. Neben DNS-Isolation und molekularbiologischen Verfahren kommen also auch histologische Verfahren (Mikrotomie, Histochemie, Fluoreszenzmikroskopie) und phylogenetische Analysen (molekulare Stammbäume) zum Einsatz.
Hintergrundinformationen zu diesem Projekt
68. Jürges, G., Beyerle, K., Häser, A., Nick, P. (2009) Development and validation of microscopical diagnostics for ‘Tulsi’ (Ocimum tenuiflorum L.) in ayurvedic preparations, Eur. Food Res. Technol. 229, 99-106 - pdf (Exemplarische Arbeit, wo wir zum ersten Mal zeigen, wie man durch die Kombination von molekularen Markern und histologischen Verfahren Surrogate von neuartigen Nahrungsmitteln nachweisen kann).
_____________________________________
Letzte Änderung: 2211.2010
© 2010 Peter Nick, Botanisches Institut, alle Rechte vorbehalten. Ihre Meinung zu unserem Webauftritt ist uns wichtig - schreiben Sie uns!