Synthetische Biologie von Mikrotubuli
Worum geht es?
Mikrotubuli sind einzigartige Biopolymere: sie sind hohl, besitzen eine Richtung, können sich selbst organisieren, zeigen eine nichtlineare Dynamik, sind biegesteif und vermitteln mit ihren Dimension die Nano- und die Mikrowelt. Es gibt viele Hinweise darauf, dass Mikrotubuli aufgrund dieser Eigenschaften bei der Wahrnehmung von mechanischen Signalen, aber auch Reizen, die davon abgeleitet sind, eingesetzt werden. Die Idee der Synthetischen Biologie ist es, biologische Strukturen in vitro zusammenzubauen, um damit zu verstehen, wie sie funktionieren.
Projektthema
Gemeinsam mit der Arbeitsgruppe Rohrbach am IMTEK in Freiburg versuchen wir diesen Ansatz auf Mikrotubuli zu übertragen, um damit die Kräfteübertragung in künstlich zusammengebauten Mikrotubuli-Netzwerken zu prüfen. Dazu werden Mikrotubuli aus fluoreszent markiertem Tubulin zusammengebaut und funktionalisiert, um sie später zum Beispiel an kleine Partikel zu koppeln, auf die dann mithilfe einer optischen Pinzette Kräfte ausgeübt werden, deren Weiterleitung in dem Mikrotubulinetz dann gemessen werden kann.
Methodik
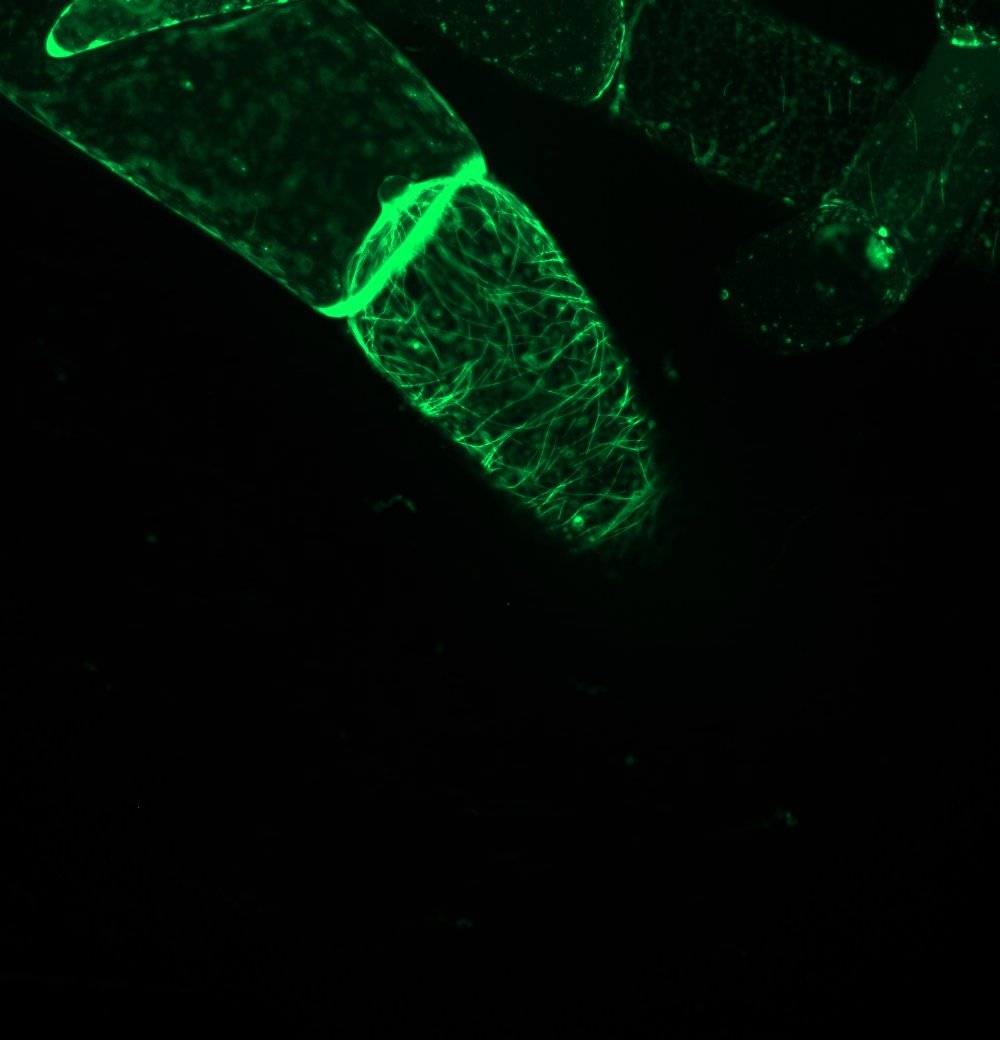
Wir haben ein pflanzliches Protein kloniert, dass an das +-Ende von Mikrotubuli bindet. Dieses ist als GFP-Fusion in einen Expressionsvektor einkloniert und wird auch in E. coli kloniert. Nach Expression und Aufreinigung kann man dann unter dem Mikroskop rot fluoreszierende Mikrotubuli zusammenbauen und dann überprüfen, wie sich die Zugabe des grün fluoreszierenden +-End-Proteins auf die Dynamik der Mikrotubuli auswirkt. In einem parallelen Ansatz soll ein „semi-synthetisches Verfahren“ sondiert werden. Hierbei werden Tabakzellen, die fluoreszente Mikrotubuli exprimieren, so prozessiert werden, dass die Mikrotubuli gebündelt und dadurch stabilisiert werden. Danach wird die Zellwand abverdaut und die daraus resultierenden Protoplasten lysiert und mit Detergentien permeabilisiert, um dann leere Mikrotubuli-Käfige zu erhalten.
Betreuung
Dipl. Biol. Natalie Schneider
Plätze
-
2 Studierende im Master (als F2, anschliessendes F3 möglich)
-
1 Studierender im Bachelor (als Modul 8)
Publikationen
Nick P (2012) Microtubules and the Tax Payer. Protoplasma special issue Applied Plant Cell Biology, Protoplasma 249 (Suppl 2), S81-S94 – pdf