Projekt Actinkäfig und Regeneration
Worum geht es?
Die Entstehung einer zellulären Richtung scheint eng mit der Wanderung und Verankerung des Zellkerns in der Zellmitte verknüpft zu sein. Diese wird durch das Zellskelett bestimmt. Als zentrale Spieler konnten wir ein merkwürdiges Geisterfahrerkinesin (KCH, ein Mikrotubuli-Motor, der hier aber verkehrt herum auf den Mikrotubuli läuft) und einen Korb von Actinfilamenten dingfest machen. Wir wollen nun verstehen, wie der Zellkern bewegt und verankert wird, wie hierbei eine Richtung entsteht und wie der Zellkern herausbekommt, wo er sich im Zellinnern gerade befindet.
Wo stehen wir?
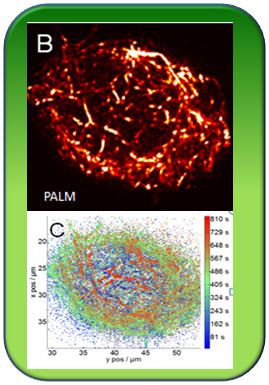
Über PALM Mikroskopie, die wir zum ersten Mal erfolgreich bei Pflanzenzellen anwenden konnten, gelang es uns, den Actinkorb in einer bis dahin nicht erreichten Auflösung von 20 nm sichtbar zu machen. Dabei fanden wir erstaunlicherweise eine Lamellenstruktur des Actins. Dieser Befund zwang uns unsere Vorstellung von der Bewegung - wir nahmen an, dass Actinfilamente an der Kernhülle ansetzen und diese hinter sich herziehen - und führte zu einem peristaltischen Modell der Bewegung, wo Actinfilamente die Kernhülle gleichsam kontrahieren und das Innere in den Hohlraum nachrutscht.
Im Brennpunkt derzeit
Die Funktion der Kernwanderung für die zelluläre Richtung lässt sich mithilfe unseres tabula rasa Modells untersuchen. Unser Peristaltik-Modell sagt voraus, dass Faktoren die entweder mit der Verankerung des Actinkorbs (das KCH-Geisterfahrerkinesin, die fluoreszente Actinsonde Lifeact-psRFP) oder mit der Architektur des Kerninneren (das Histon 2B) die Kernwanderung und damit die Regenerationsgeschwindigkeit beeinflussen können. Dies lässt sich experimentell überprüfen - indem man nämlich diese Proteine gentechnisch überexprimiert und dann das Regenerationsverhalten überprüft.
Durchführung
Nach einer Einführung in das tabula rasa System wird die Regeneration (die Entstehung einer neuen zellulären Richtung) in verschiedenen Überexpressionslinien quantitativ bestimmt.
Als Linien stehen zur Verfügung
- 35S::LA-psRFP (Actinsonde mit schaltbarem fluoreszentem Protein, markiert spezifisch den Actinkorb
- 35S::OsKCH1-GFP (Geisterfahrerkinesin aus Reis in Fusion mit GFP)
- 35S::NtKCH-GFP (Geisterfahrerkinesin aus Tabak in Fusion mit GFP)
- 35S::Histon-2B-mEOS (Histonmarker in Fusion mit schaltbarem fluoreszentem Protein)
Methodik
- Zellkultur
- Protoplastierung
- MosaiX-Aufnahmen (randomisierte Bildaufnahme)
- Klassifizierung der Regenerationsstadien im Zeitverlauf
- Spinning-disc Konfokalmikroskopie
Betreuung
M. Sci. Linda Brochhausen
Plätze
- 2-3 Studierende im Master (als F2, F3 und Masterarbeit zu dieser Thematik möglich)
Publikationen
97. Durst S, Nick P, Maisch J (2013) Actin-Depolymerizing Factor 2 is Involved in Auxin Dependent Patterning, J Plant Physiol170, 1057-1066 - pdf
103. Durst S, Hedde PN, Brochhausen L, Nick P, Nienhaus GU, Maisch J (2014) Organization of perinuclear actin in live tobacco cells observed by PALM with optical sectioning. J Plant Physiol 141, 97-108 - mehr
[21] Nick P (2010) Probing the actin-auxin oscillator. Plant Signaling Behav 5, 4-9 - pdf