Wie entsteht Polarität?
Tabula rasa. In einem pflanzlichen Gewebe bekommt jede Tochterzelle von ihrer Mutter nicht nur die Gene mit auf den Weg. Ähnlich wie eine russische Matrjoschka-Puppe vererbt die Mutterzelle auch ihre "Richtung", ihre Ordnung und Architektur. Wir haben nun verstanden, dass die Richtung der Zelle für die Selbstorganisation wichtig ist (die chemischen Schwingungen entstehen ja durch einen gerichteten Fluss des Pflanzenhormons Auxin durch den Zellfaden). Im nächsten Schritt müssen wir verstehen, wie "Richtung" neu entsteht. Dazu müssen wir die "Richtung" erst einmal entfernen, also reinen Tisch machen, um dann beobachten zu können, wie eine solche "richtungslose" Zelle von dieser tabula rasa ausgehend eine neue "Richtung" aufbaut. Nach vielen vergeblichen Anläufen ist es uns nun gelungen, durch Abverdau der Zellwand, solche richtungslosen Zellen zu entwickeln und sie dazu zu bringen, eine neue Richtung aufzubauen. Mithilfe von gentechnisch veränderten Linien, bei denen das Zellskelett über leuchtende Proteine aus Meeresquallen (Grün Fluoreszente Proteine) markiert ist, können wir nun beobachten, wie sich Actinfilamente und Mikrotubuli beim Aufbau einer neuen Zellrichtung verhalten. Ausserdem können wir prüfen, was passiert, wenn wir über chemische und gentechnische Manipulation der Aufbau und die Dynamik des Zellskeletts verändert wird. Aus diesem tabula rasa System haben wir gelernt, dass am Anfang der Zellkern erst einmal die Mitte der Zelle sucht. Wenn er die Mitte gefunden hat und dort über das Zellskelett verankert wird, bildet sich erst einmal eine neue Zellwand, die aber noch vollkommen symmetrisch ist. Im nächsten Schritt bilden die Actinfilamente ein Gefälle aus und bilden eine äußerlich noch nicht sichtbare "Spitze" aus. Danach richten sich die Mikrotubuli senkrecht zu dieser "Richtung" aus und organisieren nun die Cellulosefasern der Zellwand in derselben Orientierung. Dadurch wird die Zellwand in der einen Richtung dehnbarer und die Zelle beginnt sich wurstartig in der neuen "Richtung" zu strecken. Einen halben Tag später beobachtet man schon die ersten Zellteilungen, die strikt durch die neue "Richtung" kontrolliert sind. Ein neuer Minimalorganismus ist entstanden.
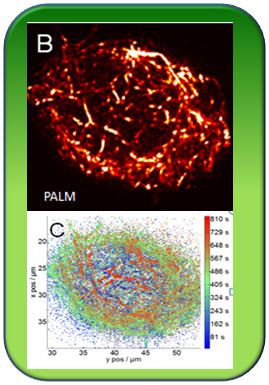
Der Zellkern als Richtungsgeber? Die Entstehung einer zellulären Richtung scheint eng mit der Wanderung und Verankerung des Zellkerns in der Zellmitte verknüpft zu sein. Diese wird durch das Zellskelett bestimmt. Als zentrale Spieler konnten wir ein merkwürdiges Geisterfahrerkinesin (KCH, ein Mikrotubuli-Motor, der hier aber verkehrt herum auf den Mikrotubuli läuft) und einen Korb von Actinfilamenten dingfest machen. Wir wollen nun verstehen, wie der Zellkern bewegt und verankert wird, wie hierbei eine Richtung entsteht und wie der Zellkern herausbekommt, wo er sich im Zellinnern gerade befindet. Über PALM Mikroskopie, die wir zum ersten Mal erfolgreich bei lebenden Pflanzenzellen anwenden konnten, gelang es uns, den Actinkorb in einer bis dahin nicht erreichten Auflösung von 20 nm sichtbar zu machen. Dabei fanden wir erstaunlicherweise eine Lamellenstruktur des Actins. Dieser Befund zwang uns unsere Vorstellung von der Bewegung - wir nahmen an, dass Actinfilamente an der Kernhülle ansetzen und diese hinter sich herziehen - und führte zu einem peristaltischen Modell der Bewegung, wo Actinfilamente die Kernhülle gleichsam kontrahieren und das Innere in den Hohlraum nachrutscht. Über Versuche mit Inhibitoren von Zellskelett und Zellwandbildung, aber auch mit transgenen Linien, bei denen bestimmte molekulare Komponenten überexprimiert sind, konnten verschiedene Aspekte der Kernwanderung sichtbar gemacht werden.
Das Projekt. Das Actinskelett ist bei tierischen Zellen über sogenannte Integrine durch die Plasmamembran hindurch mit der extrazellulären Matrix verknüpft. Diese Verknüpfung ist für die Entstehung der Zellpolarität zentral. Pflanzen besitzen keine Integrine. Allerdings kann man mit sogenannten RGD-Peptiden (das sind Heptapeptide auf der tierischen extrazellulären Matrix) das Actinskelett verändern, obwohl diese Peptide gar nicht in die Zelle hineingelangen. Man vermutet daher, dass es den Integrinen analoge Proteine gibt. Wir konnten nun beobachten, dass solche RGD-Peptide die Entstehung einer Zellpolarität in unserem tabula-rasa System stark beschleunigt. In Zusammenarbeit mit der Arbeitsgruppe von Prof. Dr. Thomas Nann von der Wellington University in Neuseeland untersuchen wir derzeit den Einfluss von Nanofasern, die mit RGD-Peptiden funktionalisiert sind. Die Idee ist es, über eine künstliche extrazelluläre Matrix eine Richtung vorzugeben und so die Polarisierung zu steuern.
Betreuung. Dr. Jan Maisch, Fortführung als Projektmodul und/oder als Masterarbeit möglich.
Publikationen
93. Zaban B, Maisch J, Nick P (2013) Dynamic actin controls polarity induction de novo in protoplasts, J Int Plant Biol 55, 142–159 - pdf
121. Brochhausen L, Maisch J, Nick P (2016) Break of symmetry in regenerating tobacco protoplasts is independent of nuclear positioning. J Int Plant Biol 58, 799-812 - pdf