Projekt Myosin
Actin und Zellpolarität
Zellpolarität, eine Art Elementarmagnet pflanzlicher Zellen, ist unserer Auffassung nach die Grundeinheit der pflanzlichen Morphogenese. Sie ist deshalb so wichtig, weil bei Pflanzen alle Zellen mehr oder minder gleichberechtigt sind, es gibt keine festgelegte Hierarchie und jede einzelne Zelle ist im Grunde in der Lage, einen eigenständigen Organismus zu bilden. Damit diese Zellen in "urdemokratischer" Weise sich selbst organisieren können, brauchen sie einen solchen inneren Kompass. Dies wollen wir verstehen. Da ein pflanzlicher Embryo ja im mütterlichen Gewebe eingeschlossen und daher schwer mikroskopisch zu beobachten ist, haben wir uns zelluläre Modelle entwickelt. Wir konnten zeigen, dass die weit verbreitete Tabak-Zellkultur BY-2 nach Zugabe von Auxin Fäden aus 6-10 Zellen bildet, die sich wie ein kleiner Minimalorganismus verhält. Die Zellen eines Fadens teilen sich nicht zufällig sondern stimmen ihre Teilung mit ihren Nachbarn ab. Unsere Forschungen ergaben, dass die Einzelzellen chemische Schwingungen erzeugen, die in einer Art chemischer Resonanz dem ganzen Zellfaden einen Rhythmus aufprägen. Dieser Rhythmus entsteht aus dem gerichteten Auspumpen von Auxin und der Reaktion des Actinskeletts auf Auxin. Actinfilamente, die Muskeln der Zelle, entspannen sich nämlich, wenn sie Auxin wahrnehmen und verkrampfen sich, wenn Auxin fehlt. Durch die Tätigkeit des Actins werden die Auxinpumpen unterschiedlich gut an ihre Wirkungsstätte, die Zellmembran, verfrachtet. Es entsteht so also ein rückgekoppelter Schwingkreis, von dem wir glauben, dass er der Schrittmacher der Selbstorganisation ist.
Warum Myosin?
Myosine sind zelluläre Motoren, die unter ATP-Spaltung entlang von Actinfilamenten wandern und dabei Frachten transportieren können. Eine dieser Frachten sind die Vesikel, die Auxin-Efflux-Carrier (sogenannte PIN-Proteine) zum Zellpol tragen. Die Zellpolarität lässt sich also letztendlich auf die gerichtete Bewegung von Myosinen zurückführen. Pflanzliche Myosine sind molekular von tierischen verschieden und werden daher in eigene Klassen geteilt - die Klasse-VIII Myosine scheinen vor allem an den Plasmodesmata zu sitzen und könnten Zell-Zell-Kommunikation steuern. die Klasse-XI Myosine sind dagegen in Pollenschläuchen am Spitzenwachstum beteiligt, also gute Kandidaten für Polaritätsmarker. Vor vielen Jahren, als die GFP-Technologie noch in den Kinderschuhen steckte, war es uns gelungen, ein Klasse-XI Myosin aus Arabidopsis durch Partikelbombardement in der Tabak-Linie VBI-0 als GFP zu fusionieren. Dabei wurde tatsächlich ein polar organisiertes Actinskelett sichtbar. Inzwischen ist erstmals eine Sequenz für ein Klasse-XI Myosin aus Tabakzellen gefunden worden und dies eröffnet uns die spannende Chance, die Rolle von Myosinen für die oben beschriebene Selbstorganisation zu prüfen.
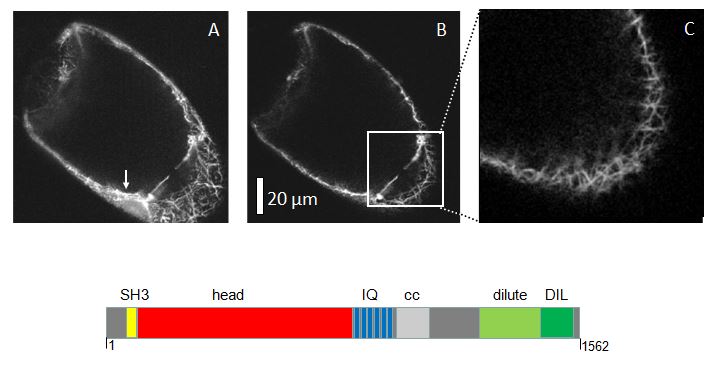
Das Projekt
Es handelt sich um ein klassisches Projekt aus der molekularen Zellbiologie: das Myosin wurde über einen RT-PCR basierten Ansatz aus BY-2 Zellen kloniert und in das sogenannte GATEWAY Vektor System eingeführt. Von hier aus kann man über eine einfache Rekombinationsreaktion das Konstrukt in verschiedene Zielvektoren (verschiedene FPs, N- oder C-terminal, verschiedene Resistenzen) umklonieren. Diese Schritte wurden im Rahmen eines Forschungsmoduls Plant Cell Biology im Herbst erfolgreich durchgeführt. Inzwischen wurde für diese Konstrukt über transiente Transformation geprüft, ob es funktionell und wie es lokalisiert ist. Dies war erfolgreich, es zeigte sich, dass ein corticales Netzwerk von Actin markiert wird (so wie es vor über 20 Jahren schon für die ersten Versuche mit Mya2 aus Arabidopsis beobachtet wurde). Inzwischen konnten auch stabile Transformanten erzeugt werden, so dass eine Phänotypisierung möglich wird. Damit lassen sich über die Lokalisation hinaus Informationen über die Funktion dieses Myosins gewinnen. Dies kann, abhängig von Zeit und Verlauf der Kultivierung, durch Inhibitorstudien ergänzt werden. Neben dem generellen ATPase Blocker 2,3 Butane Dione Monoxime (BDM) kann hier der für bestimmte Gruppen tierischer Myosine spezifische Inhibitor Blebbistatin eingesetzt werden.
Geeignet für 2 Master-Studierende