Willkommen im Nick-Labor
↵
 |
Molekulare Zellbiologie (Prof. Dr. Peter Nick)Fritz-Haber-Weg, Gbd. 30.43 (Biologieturm), 5. Stock. e-mail. So finden Sie uns Living is Searching (Springer-Nature 2023)
Sekretariat
|
ProtoplasmaDie Zeitschrift für Zellbiologie mit der längsten Tradition. mehr...
|
|
|
Der neue "Strasburger"Vor 127 Jahren begründete Eduard Strasburger das Lehrbuch der Botanik. Jetzt ist die 38. Auflage erschienen - damit ist der Strasburger das Biologielehrbuch mit der längsten Geschichte. Peter Nick steuerte einige 100 Seiten zu den Themen Struktur und Funktion des Pflanzenkörpers und pflanzliche Entwicklung bei. Der "Strasburger" verfolgt den Anspruch, das gesamte Wissen über Pflanzen umfassend, aktuell und dennoch gefiltert darzustellen. Auch wenn es noch nie so einfach war, sich Informationen zu beschaffen, besteht das Problem zunehmend darin, nach relevant und irrelevant zu filtern. Lehrbücher sind also nicht obsolet, sie sind wichtiger denn je. mehr... |
FKIDer Lehrpreis des Landes 2015 ging an Peter Nick and Mathias Gutmann. Mit dem Preisgeld bauten wir das Forum auf, um über die Grenzen von Fakultäten und Disziplinen kontroverse Themen zu hinterfragen und zu diskutieren. Im WS 2025-2026 geht es um ein zentrales Konzept der Biologie, die Zelle. mehr...
ARTTI Podcast über Gentechnik in der Landwirtschaft. mehr...
|
 |
Mathias GroteForum für Kritische Interdisziplinarität (FKI). Mathias Grote, Universität Greifswald, Di, 17. Februar 2026, 14-15:30. Seminarraum beim Forum (Gbd. 30.95, 1. Stock): Planetary Microbes: The work and legacy of Lynn Margulis from serial endosymbiosis to Gaia theory. I will analyze the work of US cell and microbiologist Lynn Margulis (1938 – 2011), often called a “rebel” of biology for her proposal of the theory of the formation of eukaryotic cells by serial endosymbioses, which has become textbook knowledge today, the concept of the “holobiont” as well as (with James Lovelock) of Gaia theory. This latter has been discussed controversially especially in evolutionary biology. Thereby, Margulis has argued since the 1980s for the role of microbes for cellular evolution, biogeochemistry and ecology. The fact that Margulis is seen a trailblazer of a novel biology in the early 21st century obscures that much of her research was carried out collectively. I will present a different interpretation by investigating the role of the NASA-sponsored Planetary Biology Microbial Ecology program for the spread of her ideas and concepts, which included summer courses in California and Mexico, hands-on instruction at the sea as well as community building. Thereby, I propose a social and historical answer to the question of how new ideas spread. |
|
|
|
Mikrotubuli und die Hunde der HölleZerberus, der dreiköpfige Höllenhund bewacht in der griechischen Mythologie das Totenreich Hades. Herkules gelang es, den Hund an die Leine zu nehmen und so in die andere Welt vorzudringen. Es scheint, als ob diese Metapher auch für die pflanzliche Immunreaktion taugt: bei der sogenannten Hypersensitiven Reaktion begeht die befallene Zelle Harakiri und reißt den Angreifer mit in den Tod. Ausgeführt wird dieser zelluläre Selbstmord über sogenannte Metacaspasen, proteinabbauende Enzyme, deren Namen sich von den Caspasen ableitet, dem Gegenstück bei der tierischen Apoptose (die Proteine sind aber nicht evolutionär verwandt). Wie wird jedoch verhindert, dass diese Höllenhunde nicht auch bei gesunden Zellen loswüten und Tod und Verderben bringen? Wir haben diese Frage an Zellen der Weinrebe untersucht und herausgefunden, dass die zentrale Metacaspase 5 an die Mikrotubuli, einem wichtigen Bestandteil des pflanzlichen Zellskeletts, gebunden sind. Wenn die Zelle eine Attacke wahrnimmt (im Experiment durch ein chemisches Signal simuliert), baut sie die Mikrotubuli ab und lässt damit Zerberus von der Leine, der binnen weniger Stunden ganze Arbeit leistet. Wir zeigen dies in einer Verbindung von zellbiologischen und biochemischen Ansätzen und haben damit eine zuvor unbekannte Funktion der Mikrotubuli gefunden. Veröffentlichung 222. Zhu X, Zhang K, Gong P, Riemann M, Nick P (2025) Unleash the Dogs of Death: Vitis Metacaspase 5, Microtubules, and Hypersensitive Response. Plant Cell Reports, doi 10.1007/s00299-025-03567-x - pdf
|
|
 |
Neues Projekt im Bereich Vertical FarmingAm 1. November beginnt ein neues Kooperationsprojekt mit dem Start-up Vertical Farming und dem Max-Rubner-Institut, gefördert vom Bundesministerium für Landwirtschaft, Ernährung und Heimat. Laufzeit ist drei Jahre. In einem vom Land Baden-Württemberg geförderten Vorgängerprojekt wurde in der Versuchsanstalt des JKIP ein Prototyp für eine Vertical Farm Installation getestet, bei dem die Bildung von wertgebenden Inhaltsstoffen durch wiederholte Schwerkraftreizungen stimuliert wurde. In diesem Zusammenhang wurde entdeckt, dass durch Aeroponik (Besprühen mit einem Nährstoffnebel) das Wurzelwachstum in bisher nie gekanntem Ausmaß gesteigert werden kann. Das neue Projekt will nun diese Entdeckung weiterentwickeln. Es geht um hochpreisige Rhizompflanzen wie Ingwer, Curcuma oder Wasabi. Um die kostbaren Produkte vor Befall durch Krankheitserreger zu schützen wird eine neue Technologie getestet, wobei die Wurzeln mit von uns identifizierten Wurzelbakterien behandelt werden, die in der Lage sind, das pflanzliche Immunsystem zu stimulieren. Auf diese Weise hoffen, wir, dass man nicht nur chemische Pflanzenschutzmittel vermeiden kann, sondern auch auf die im Bereich Vertical Farming extremen Quarantänestandards verzichten kann, was die Kosten stark absenken und den Wirkungskreis dieser neuen Anbaumethode beträchtlich erweitern würde. |
|
 |
EvoDevo der Artbildung"Art" ist ein zentraler biologischer Begriff und wird in der Regel im Sinne von Fortpflanzungsgemeinschaft verstanden. Dieser Artbegriff funktioniert bei Tieren sehr gut, weil hier Paarungen zwischen Individuen verschiedener Arten in der Regel nicht funktionieren oder steril bleiben (klassisches Beispiel wäre das Maultier). Pflanzen wählen jedoch ihren Geschlechtspartner nicht selbst, sondern nutzen die Hilfe von Insekten dafür. Außerdem können Pflanzen bei Störungen der geschlechtlichen Fortpflanzung sich mit asexueller Fortpflanzung behelfen. Was ist nun eine "Art" bei Pflanzen? Dr. Sascha Wetters hat hierzu ein neues Konzept vorgeschlagen, wonach Gene, die Blütenform oder -geometrie verändern Treiber der Artbildung sind. Um diese Idee zu prüfen, hat er sich eine harte Nuss vorgenommen - die Gattung Salbei, mit über 1000 bekannten Arten, eine der vielfältigsten Gattungen überhaupt. Hier kann er zeigen, dass eine Verdopplung des Genschalters GLOBOSA dazu führte, dass Salbei bei Besiedlung der Neuen Welt über Vergrößerung seiner Blüten und Veränderung ihrer Asymmetrie neue Bestäuber, nämlich Kolibris, rekrutieren konnte, wodurch zahlreiche neue Arten entstanden. Damit schlägt er eine Brücke zwischen Entwicklungsbiologie und Evolution. Diese Arbeit ist nun veröffentlicht worden: 217. Wetters S, Nick P (2025) B-class gene GLOBOSA – a facilitator for enriched species diversity of Salvia in the New World? Plant Biol, 10.1111/plb.70002 - pdf |
|
Was wir forschen
↵
 |
Evolution löst Probleme nachhaltig, auf vielfältige Weise. Können wir diese Vielfalt nutzen? Wir wollen Biodiversität schützen und nutzen. Wir entwickeln Methoden, um Verbraucherschutz in Zeiten der Globalisierung zu sichern. mehr... |  |
In unserem von Interreg Oberrhein geförderten Forschungsverbund nutzen für Resilienzfaktoren aus der fast ausgestorbe-nen Europäischen Wildrebe, um KliWi-Reben (für Klima-Widerstandsfähig) zu entwickeln. mehr... |
 |
Pflanzen sind Meister der Anpassung. Wie meistern sie Stress? Wir arbeiten an Jasmonsäure, dem pflanzlichen "Adrenalin", aber auch über das Immunsystem der Weinrebe. mehr.. |   |
Gemeinsam mit Partnern in Colmar und Basel versuchen wir im Projekt "Roots of Resilience" die Immunität von Weinreben über von uns identifizierte Wurzelmikroben zu stimulieren mehr... Gemeinsam mit dem start-up Vertical Farm Tech und dem Max-Rubner Institut entwickeln ihr im Projekt "VFT4Hero" eine Vertical Farm Strategie für die Superfood-Pflanzen Ingwer, Curcuma und Wasabi. |
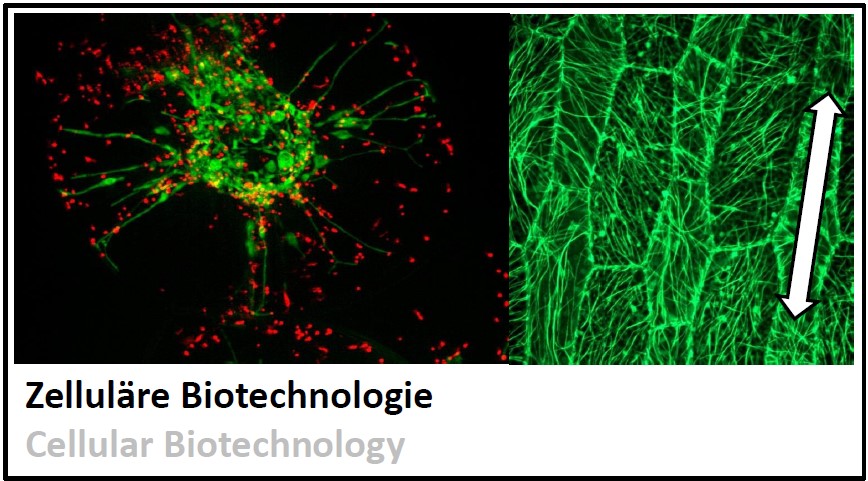 |
Pflanzenzellen können Selbstorganisation ohne einen "Big Brother". Die Fähigkeit jeder einzelnen Zelle, sich selbst eine Richtung zu geben, ist hier zentral. Wie geht das? mehr... |  |
Hygrophila, ein neues Modell, um Anpassung an Stress zu untersuchen steht im Zentrum der Forschungen von Dr. Jathish Ponnu und seinem Team (Wild Ideas Programm, 2025-2026). mehr... |