2017_05: Wie funktioniert der Mikrotubuli-Thermometer?
Worum geht es?
Pflanzen können nicht davonlaufen, wenn ihnen die Umwelt nicht passt. Sie müssen sich anpassen. Um sich anpassen zu können, müssen sie zunächst wahrnehmen können, dass sich die Umwelt zu ihren Ungunsten verändert hat. Besonders dramatisch ist dies im zeitigen Frühjahr, wenn die jungen Blätter sich nach einer Wärmeperiode einem plötzlichen Frosteinbruch gegenübersehen (so wie in diesem Frühjahr). Nur wer die Kälte schnell wahrnehmen und so schnell reagieren, beispielsweise durch die Bildung von Frostschutzproteinen, wird überleben. Die Bedeutung der Kältewahrnehmung für die Landwirtschaft liegt auf der Hand.
Wie Kälte, ein physikalischer Reiz, in eine letztendlich chemische Veränderung der Zelle, übersetzt wird, ist alles andere als einfach zu verstehen. Wir vermuten, dass hier die Mikrotubuli als „Übersetzer“ fungieren. Diese Bausteine des sogenannten Zellskeletts wurden viele Jahre vor allem als Teil der Zellarchitektur gesehen und auch entsprechend untersucht. Seit etwas mehr als zwei Jahrzehnten arbeiten wir an der Idee, dass die Mikrotubuli auch eine Sinnesfunktion haben, vor allem für physikalische Reize, wie Berührung, Verletzung, aber auch osmotischen Stress. Schon lange vermutet man, dass die Zelle niedrige Temperaturen letztlich dadurch wahrnimmt, dass in der Kälte die Zellmembran weniger flüssig ist.
In der Tat bauen sich die Mikrotubuli ab, wenn sie abgekühlt werden. Dies könnte dazu führen, dass Calciumkanäle, die durch Mikrotubuli kontrolliert werden, aufgehen und der so ausgelöste Einfluss von Calcium als chemisches Signal fungiert. In einer früheren, inzwischen sehr viel zitierten Arbeit (Abdrakhamanova et al. 2003) konnten wir zeigen, dass sibirischer Winterweizen deshalb so gut mit Frost zurechtkommt, weil die Mikrotubuli in einer frühen Phase sehr sensitiv reagieren und sich besonders schnell abbauen, wodurch die Anpassungsreaktionen besonders schnell und stark angeschaltet werden.
Doch wie werden die Mikrotubuli dazu veranlasst, sich in der Kälte aufzulösen?
Unser Werkzeug: Rebenzellen mit leuchtenden Mikrotubuli
Um die Rolle des Zellskeletts für die pflanzliche Abwehr untersuchen zu können, hatten wir im Rahmen des Interreg-Projekts BACCHUS Rebpflanzen und Zellkulturen entwickelt, bei denen das Zellskelett mithilfe eines fluoreszenten Proteins aus einer Qualle sichtbar gemacht wurden, so dass man den Zellen in flagranti dabei zusehen kann, wie sie auf einen bestimmten Reiz reagieren. Eine Rebenzellkultur mit leuchtenden Mikrotubuli wurde nun zum zentralen Werkzeug in dieser Arbeit: Durch Behandlung mit Eiswasser wurden die Zellen einem Kälteschock ausgesetzt und wir konnten beobachten und auch messen, wie sich die Mikrotubuli dabei auflösen. Im nächsten Schritt behandelten wir die Zellen mit verschiedenen Hemmstoffen, von denen wir wussten, dass sie bestimmte Schritte der Signalverarbeitung unterbrechen. Wir prüften nun, ob die Mikrotubuli noch auf die Kälte reagierten oder nicht. Wenn sie nicht mehr reagierten, wussten wir also, dass der entsprechende Signalschritt für die Funktion des Mikrotubuli-Thermometer notwendig war. In manchen Fällen fanden wir auch Wege, wie wir diese Schritte bei Normaltemperatur (also ohne Kältereiz) auslösen konnten. Wenn nun die Mikrotubuli darauf reagierten, also ob sie gerade einen Kälteschock erlitten hätten, sich also auflösten, wussten wir, dass der entsprechende Signalschritt für die Kältemessung hinreichend war.
Was kam heraus?
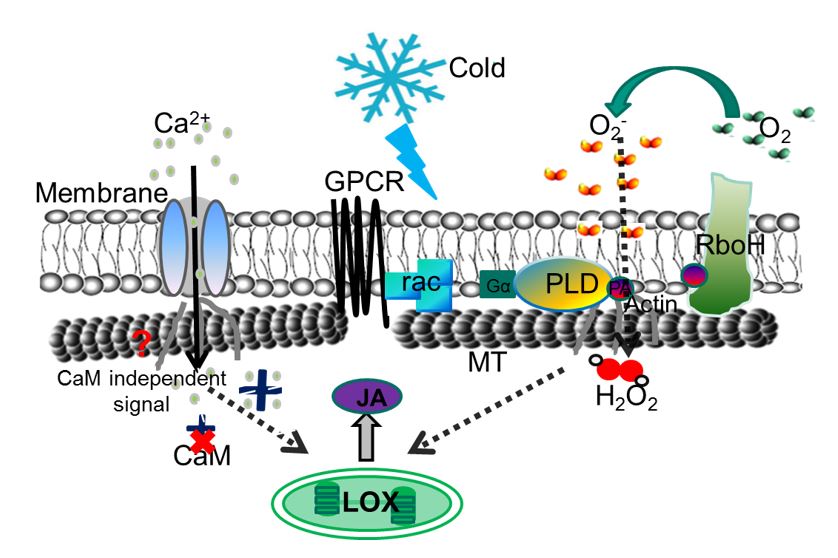
Schritt für Schritt konnten wir so einige Elemente des Thermometers dingfest machen und daraus ein sogenanntes Arbeitsmodell entwickeln. Dieses Modell ist sicherlich nicht vollständig und wir wissen auch nicht, ob es wahr ist – zumindest kann es alle unsere experimentellen Befunde zwanglos erklären, auch solche Phänomene, die auf den ersten Blick überraschend scheinen. Dieses Modell nimmt an, dass durch die Abkühlung die Membran weniger flüssiger wird. Dies regt das Enzym RboH (Respiratory burst oxidase Homologue) an, wodurch an der Außenseite der Zelle Sauerstoff zu Superoxid reduziert wird. Superoxid dringt in die Zelle ein und aktiviert das Signalprotein rac, was wiederum Phospholipase D und, in einer Rückkopplung, RboH, aktiviert. Die Mikrotubuli, die über Phospholipase und auch über Actinfilamente an die Innenseite der Membran gefesselt sind, werden nun losgelassen – unter anderem dadurch, dass Superoxid eine Ablösung des Actinankers und eine Kontraktion des Actins auslöst. Die durch diese Ablösung schon destabilisierten Mikrotubuli werden nun durch das einströmende Calcium sehr schnell zum Abbau gebracht – wie das funktioniert, ist noch nicht klar. Wir hatten zunächst vermutet, dass Calcium über Aktivierung von Calmodulin den Abbau hervorruft – ein Mechanismus, den man von tierischen Zellen her kennt. Wenn diese Idee richtig gewesen wäre, sollte eine Hemmung von Calmodulin den Abbau stoppen. Tat sie aber nicht, daher mussten wir hier einen möglichen Faktor, Calmodulin, ausstreichen. Wir konnten zum Ausgleich Einblick in die nachfolgenden Prozesse gewinnen – durch die Kältereizung wird nämlich Jasmonsäure (das „Adrenalin der Pflanze“) gebildet und dies wirkt auch wieder auf die Mikrotubuli zurück.
Der Mikrotubuli-Thermometer ist also ein auf sich selbst zurückwirkender Prozesse, die sich immer mehr verstärken, bis am Ende die Mikrotubuli abgebaut werden. Momentan arbeiten wir an der Frage, wie die an der Membran stattfindende Auflösung der Mikrotubuli, dass im Zellkern, also an einem ganz anderen Ort, Gene aktiviert werden, die zur Kälteabhärtung führen. Wir haben hier schon erste überraschende Einblicke gewinnen können, aber die seien jetzt noch nicht verraten.
Veröffentlichung
134. Wang L, Nick P (2017) Cold sensing in grapevine - which signals are upstream of the microtubular “thermometer". Plant Cell Environment 40, 2844-2857 - pdf