2017_01 Elektropulse schalten Stress-Anpassung
Was war die Motivation?
Stress gehört zum Leben dazu - kein Lebewesen ist die ganze Zeit im Gleichgewicht. Ständig wird über ein feines und flinkes Netzwerk von Regelkreisen das Gleichgewicht immer wieder hergestellt. Es gibt aber Situationen, da geht es um die Wurst - wenn nämlich die Integrität der Zelle so sehr gestört wird, dass sie nicht mehr in der Lage ist, das Gleichgewicht wieder zu erreichen. Die Außenseite einer Zelle, ihre Membran, ist der Ort, an dem die zelluläre Integrität am verwundbarsten ist. In der Vergangenheit konnten wir herausarbeiten, dass ein sehr dynamischer Teil des Actin-Skeletts über Messung reaktiver Sauerstoff-Spezies Störungen der Membran-Integrität wahrnehmen kann (Chang and Nick 2015, Eggenberger et al. 2017). In Antwort darauf wird das Wachstum eingestellt und eine Stress-Antwort ausgelöst. Ebenso wird der Zellzyklus angehalten und entweder eine Zell-Differenzierung, in manchen Fällen sogar ein programmierter Zelltod eingeleitet. Wenn dieses Arbeitsmodell zutrifft, sollte man selbst über milde Störung der Membran-Integrität solche Reaktionen der Stress-Anpassung auslösen können.
Idee: Nanosekunden-Strompulse als Auslöser
Seit mehr als einem Jahrzehnt arbeiten wir mit der Gruppe von Dr. Wolfgang Frey am Institut für Hochleistungsimpuls- und Mikrowellentechnologie (IHM) am KIT-Campus Nord zusammen. Es geht dabei um den Einfluss von ultrakurzen (Nanosekunden), aber ultrastarken (kilo-Volt pro cm) elektrischen Pulsen auf Pflanzenzellen. In früheren Arbeiten konnten wir zeigen, dass solche nsPEFs (für nanosecond Pulsed Electrical Fields) eine schnelle Ablösung des Actins von der Membran hervorrufen, was die Zelle dann in den programmierten Zelltod (die pflanzliche Version der Apoptose) treibt. Die Idee war nun, mithilfe von nsPEFs gezielte Stressreaktionen auszulösen. Objekt der Wahl waren einzellige Mikroalgen, weil hier schon im Rahmen eines von der Landesstiftung Baden-Württemberg geförderten Projekts biotechnologische Anwendungen untersucht wurden. Ausserdem lassen sich an diesen Algen elektrische Felder auf einfache Weise über eine Pulskammer applizieren.
Was kam heraus?
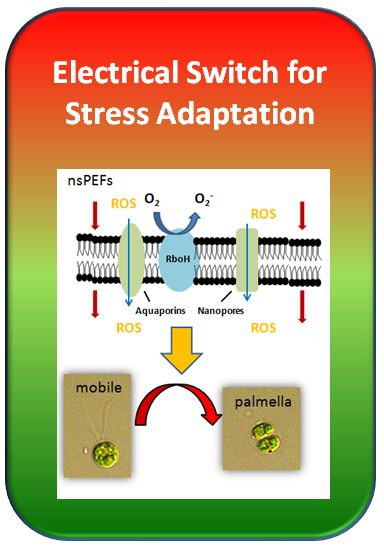
Zuerst mussten die Energien so eingestellt werden, dass die Algen (wir arbeiteten mit der einzelligen Grünalge Chlamydomonas reinhardtii) zwar gereizt, aber nicht geschädigt wurden. Aufgrund von langjährigen Vorarbeiten mit anderen Zellen waren die Parameter schon einigermaßen bekannt. Durch die Elektropulse wurden kleine Membranporen hervorgerufen, die aber schon nach wenigen Minuten wieder versiegelt waren, gleichzeitig schwollen die Zellen etwas an, aber innerhalb einer Stunde nach dem Puls hatten sie ihre normale Größe wieder erreicht und schienen den Stromstoß "gut weggesteckt" zu haben. Wir beobachteten jedoch einen starken Anstieg der Lipidperoxidation, was auf die Bildung reaktiver Sauerstoff-Spezies (ROS) hindeutete. Aber auch dieser "oxidative Ausbruch" verebbte nach ein paar Stunden wieder. Wir dachten zunächst, es sei alles wie zuvor, die Pulse hätten also keine Spur hinterlassen. Weit gefehlt! Wenige Tage später stellten die behandelten Zellen ihre Teilung ein, schwollen wieder an und entwickelten eine zweite, massive Welle der ROS-Bildung. Und dann warfen sie ihre Geißeln ab und umgaben sich mit einer Gallerthülle. Dieses Palmella-Stadium tritt gewöhnlich auf, wenn ein Algentümpel austrocknet, stellt also eine Anpassung an Austrocknung dar. Die Elektrobehandlung löste also ein Signal aus, dass mehrere Tage überdauert und dann eine Entwicklungs-Reaktion aktiviert. Wir vermuteten, dass dieses Signal aktiv in Antwort auf Störungen der Membran-Integrität erzeugt wird. Als Sensor dient hier vermutlich das in der Membran sitzende Enzym NADPH-Oxidase, was auf der Außenseite der Zelle Sauerstoff zu Superoxid umwandelt. Superoxid gelangt gewöhnlich nur schlecht durch die Membran hindurch. Wenn aber die Integrität der Membran auch nur zeitweise gestört wird, kann Superoxid in die Zelle eindringen und eine Lipidperoxidation hervorrufen, wodurch vielleicht auch das (unbekannte) Palmella-Signal gebildet wird. Wenn diese Idee stimmt, sollte eine Hemmung der NADPH-Oxidase die in Antwort auf nsPEFs aktivierten langfristigen Stress-Reaktionen hemmen können. Mithilfe von sehr geringen (2 µM) Konzentrationen des Hemmstoffs Diphenylen-Iodonium Chlorid (DPI), konnten wir diese Vorhersage experimentell bestätigen.
Was bedeutet das?
Schon bei den einzelligen Grünalgen scheint ein Sensor für Zell-Integrität zu existieren, der das Eindringen von Superoxid durch die Membran misst und dann Anpassungs-Reaktionen der Zelle aktiviert. Dasselbe hatten wir auch schon für Zellkulturen von Tabak und Wein gezeigt (Chang and Nick 2015, Eggenberger et al. 2017). Man kann mit nsPEFs also sehr spezifisch in die Signalverarbeitung eingreifen. Was heisst das für die biotechnologische Anwendung? Wenn man die Biologie versteht, kann man Organismen sehr gezielt manipulieren, ohne hierfür große Energiemengen einsetzen zu müssen.
Veröffentlichung
130. Bai F, Gusbeth C, Frey W, Nick P (2017) Nanosecond pulsed electric fields trigger cell differentiation in Chlamydomonas reinhardtii. BBA Membranes 1859, 651-661 - pdf